Thermodynamique (CHIMIE 02) -S2-ST-2023/2024
مخطط الموضوع
-

Faculté: Technologie
Département: Electrotechnique
Spécialités : ST
Intitulé du cours : Thermodynamique
Crédit: 4
Coefficient: 3
Enseignant chargé de cours : Dr. BOUACHA Samir
Contact par mail : samir.bouacha@univ-msila.dz -

Faire acquérir à l’étudiant des méthodes thermométriques, des connaissances sur les normes, les paramètres permettant d’optimiser le rendement thermodynamique d’une machine thermique - Aborder les rendements thermodynamiques des machines thermiques sur la gestion de l’énergie et son impact sur l’environnement -

Faire un bilan énergétique
Calculer une quantité de travail ou de chaleur pour des transformations de base
Appliquer les deux premiers principes
Déterminer les fonctions d’état (énergie interne, enthalpie, entropie)
Faire des essais sur des machines thermiques avec des tracés de cycle sur diagrammes. -
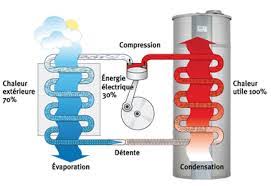
D’origine grec, le mot thermodynamique est composé de deux parties : «thermo» qui veut dire chaleur et «dynamique» qui signifie travail ou mouvement. Le mot composé veut dire mouvement produit à partir de la chaleur. La thermodynamique est apparue en tant que science à partir du XVIII siècle avec la création de la machine à vapeur.
-
المحادثة
-
الإفادة
-
منتدى
-
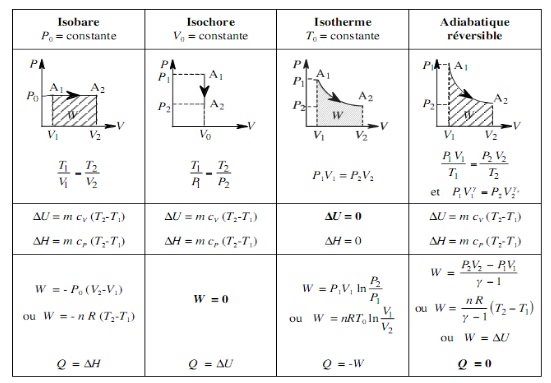
Tout système possède une certaine quantité d’énergie qui peut se présenter sous différentes formes. Ainsi, l’énergie totale stockée dans un système est la somme de deux types d’énergie.
-
المحادثة
-
الإفادة
-
منتدى
-
Dans toute réaction chimique, l'état énergétique des produits est différent de celui des réactifs : il y aura donc absorption ou dégagement d'énergie lors de la transformation des réactifs en produits. Lorsqu'il s'agit d'énergie thermique, on dit que laréaction est soit exothermique (dégagement de chaleur), soit endothermique (absorption de chaleur ). L'étude de ces échanges d'énergie thermique au cours des réactions chimiques constitue la thermochimie. La chaleur de réaction est proportionnelle à la quantité de substance mise en oeuvre et dépend des conditions dans lesquelles la réaction s'effectue. On devra donc préciser ces paramètres dans la définition de la chaleur de réaction.

-
المحادثة
-
الإفادة
-
منتدى
