Chimie Analytique
Topic outline
-
-
Forum
-
-
-
- Faculté :Faculté des sciences
- Département : Chimie
- Public cible : 2 ème année chimie
- Intitulé du cours :Chimie analytique
- Crédit :4
- Coefficient :2
- Durée : 12 semaines
- Horaire : 2 H cours 1h:30 TD
Enseignant :
Chargée de module : Dr .Zoulikha BAKOUR
Contact : zoulikha.bakour@univ-msila.dz
Disponibilité :Au bureau : lundi, de 11h00 -12h00
- Faculté :Faculté des sciences
-
-
-
L’enseignement de cette matière permet à l’étudiant d’acquérir les bases de l’analyse des
produits, c'est-à-dire l'identification et la caractérisation de substances chimiques connues
et à la chimie des réactions en milieux aqueux.
-
-
-
Chapitre 1. Equilibres en solution
Chapitre 2. Oxydo-réduction
Chapitre 3. Les solutions ioniques. Acides et Bases
Chapitre 4. Le pH des acides et des bases
Chapitre 5. Les sels en solution.
-
-
-
Quiz

-
-
-

Dans ce chapitre, vous verrez les concepts importants et les caractéristiques liés aux réactions à l’équilibre. Ainsi, vous verrez l’expression des constantes d’équilibre en fonction des concentrations et des pressions partielles de même que l’expression du quotient réactionnel en plus de plusieurs exemples et exercices. Une partie importante de ce chapitre concerne le principe de Le Chatelier, son principe et l’effet de celui-ci en réponse à diverses contraintes appliquées à un système. Ce chapitre se termine par l’utilisation de bilans réactionnels pour trouver la valeur de la constante d’équilibre et des concentrations ou des pressions partielles des composés à l’équilibre. N’oubliez pas de visionner l’animation du principe de Le Chatelier et de faire les questionnaires et les problèmes dans l’onglet exercices pour vérifier votre compréhension de l’équilibre chimique
-
Chat
-
Forum
-
-
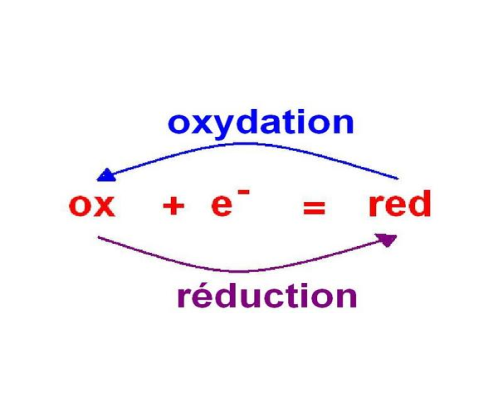
Les réactions d'oxydoréduction mettent en jeu un réducteur (Red) et un oxydant (Ox) :
• Oxydant (Ox) = substance susceptible de fixer des électrons
• Réducteur (Red) = substance susceptible de céder des électrons
-
-
Les réactions acide-base sont des réactions chimiques qui s’effectuent par échange protonique entrel’acide d’un couple1et la base d’un autre couple 2. Ainsi, une réaction acido-basique fait intervenir descouples acide/base de demi-réaction acide-base
-
Forum
-
L’échelle de pH (potentiel en hydrogène) donne une mesure de l’acidité en mesurant la concentration en
ions hydronium (H3O+ ou H+) d’une solution aqueuse : pH = - log [H3O+]-
Forum
-
-

1- J. L. BRISSET, A. ADDOU, M. DRAOUI, D. MOUSSA, F. ABDELMALEK, Chimie analytique
en solution (2ème Ed.) : Principes et Applications, Ed. Lavoisier, (2011).
2- J.-L. BURGOT, Chimie analytique et équilibres ioniques, (2ème Ed.), Ed. Lavoisier, (2011).
3- P. A. GAUCHARD, Chimie – Chimie Physique, Université Joseph Fourier de Grenoble (2011).
4- S. EL FILALI, Chimie des solutions -M.P.S.I, Lycée technique Mohamed V, Centre des classes préparatoires Béni Mellal
5- C.B. Monk, 1961. Electrolytic Dissociation - Academic Press, London.
6- P. Debye, E. Hückel. 1923 - Physik. Z., 24, p. 185.
7- J. Larcher, Université de Strasbourg – Faculté de Chimie - Licence de Chimie Réactivité Chimique.
8- Y. Delhaye, cours de chimie. 2010
9- C. Coulon, Equilibres chimiques cinétique chimie en solution aqueuse, Université sciences technologies, Bordeaux.
10- B. Leyh, R. Wuytack, R. Cahay, V. Collignon, A. Cornélis G. Kroonen, Les équilibres chimiques, Université de Liège Section de Chimie. 2002
-
