Travaux Pratique de Chimie I (TP Chimie 01) 2022-2023
Topic outline
-
-
Forum
-
-

Enseignant : Dr. MAKHLOUFI El-Hani

Contact : makhloufi_el_hani@yahoo.fr
Disponibilité : Au Laboratorie : Mercredi- Jeudi de 08h00 -17h00
Informations sur le cours :
Faculté : Technologie
Département : Socle Commun ST
Public cible : 1ère année Licence
Intitulé du cours : TP Chimie 01
Crédit : 02
Coefficient :01
Durée : 10 semaines
Horaire : 03h00
Bloc: B
Salle : Labo: 5 - 9.2022 - 2023
-
Ces séances de travaux pratiques est destiné aux étudiants de la 1ère année Socle commun, Le module de travaux pratiques de chimie I sont composés de cinq manipulations:
- Manipulation N°1 : Notions générales (Sécurité, Appareils de mesure au Laboratoire)
- Manipulation N°2 : Préparation des solutions.
- Manipulation N°3 : Dosage colorimétrique d’un acide fort par une base forte.
- Manipulation N°4 : Dosage d’oxydo-réduction.
- Manipulation N°5 : Dosage du vinaigre.

Chaque travail pratique est accompagné de renseignements théoriques et des questions sont proposées, afin de contrôler l’acquisition et l’assimilation des connaissances. et Chaque manipulation est sanctionnée par un compte-rendu remis à l'enseignant dans un délais maximum de 15 jours à compter de la date de la manipulation.
-
Le travail dans un laboratoire de chimie nécessite une application d'un certain nombre de règles de sécurité ; ces règles sont indispensables pour l'organisation d'un travail dans un laboratoire. Lorsque vous rentrez pour la première fois en salle de TP, l'étudiant devra savoir quoi faire, savoir comment se vêtir et se comporter lors d’une séance de TP, connaître les règles essentielles de manipulation du matériel et des produits chimiques, la verrerie couramment utilisée et savoir rédiger son compte rendu.


Travailler dans un laboratoire de chimie expose à des risques dus aussi bien aux produits chimiques potentiellement toxiques qu’au matériels utilisés qu’un expérimentateur doit connaître pour les utiliser sans danger. Il faut ainsi avoir conscience des risques encourus et tout faire pour protéger les autres et soi-même, tout en gardant en tête que le danger peut venir d’autrui.


- Quelques règles générales de sécurité.
- Quelques outils et instruments du laboratoire de chimie.
-
Chat
-
Forum
-
Feedback
-
La mesure précise des volumes est d'une grande importance au laboratoire. Elle peut être effectuée à l'aide d'une pipette jaugée ou graduée, d'une burette graduée ou d'une fiole jaugée. Nous allons montrer dans cette séquence comment préparer ou diluer une solution en utilisant une fiole jaugée pour contenir un volume précis de liquide.
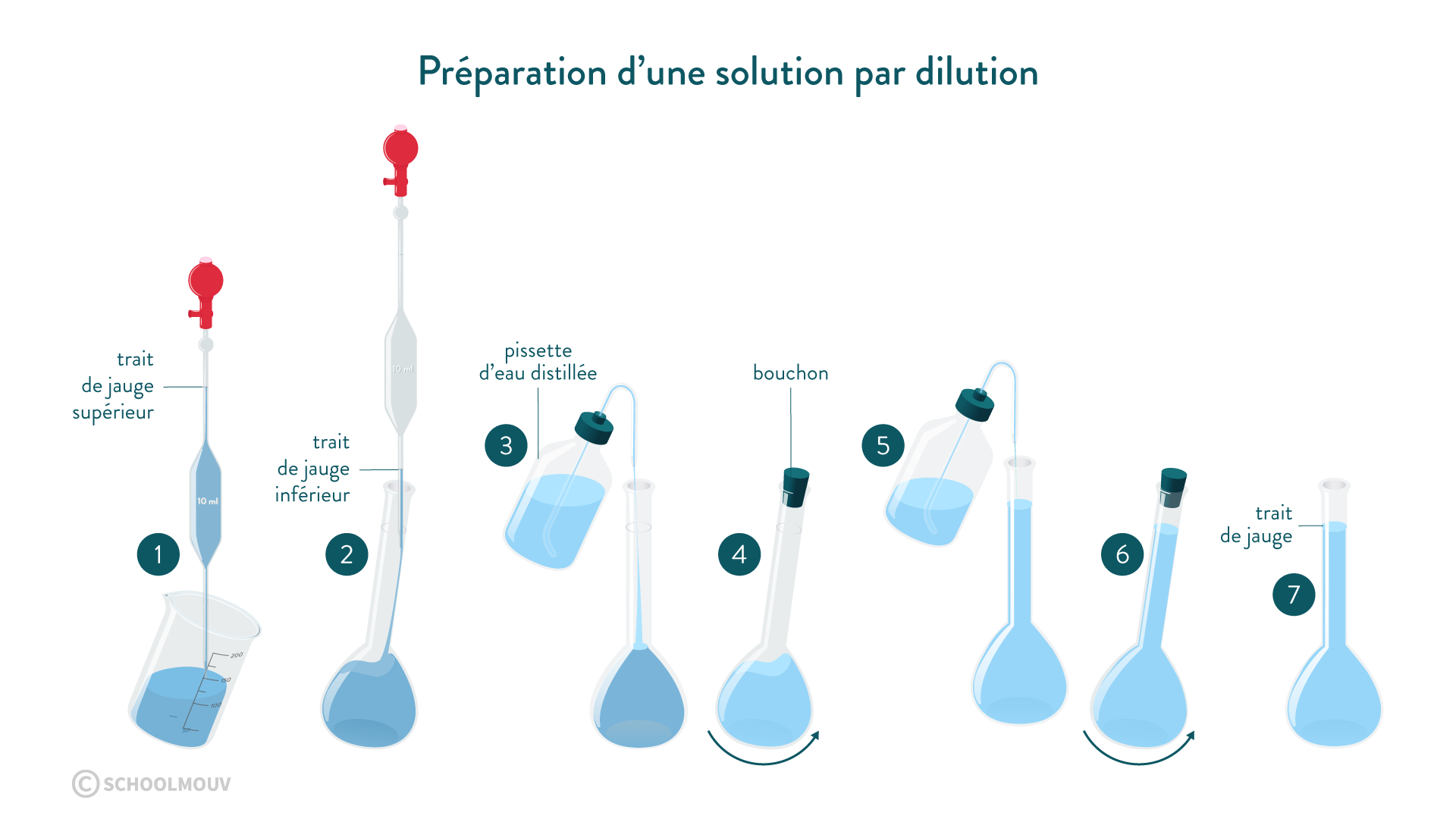


- Préparation d'une solution par dissolution.
- Préparation d'une solution par dilution.
-
Chat
-
Forum
-
Feedback
-
Dans la vie courante, nous utilisons régulièrement des solutions acides ou basiques : détartrant, vinaigre, jus de citron, ammoniaque, soude, etc. Un acide est fort si sa réaction avec l'eau peut être considérée comme totale et qu'il ne subsiste alors en solution que sa base conjuguée. La réaction de cet acide fort AH s'écrit alors de la manière suivante : AH + H2O → A - + H3O+
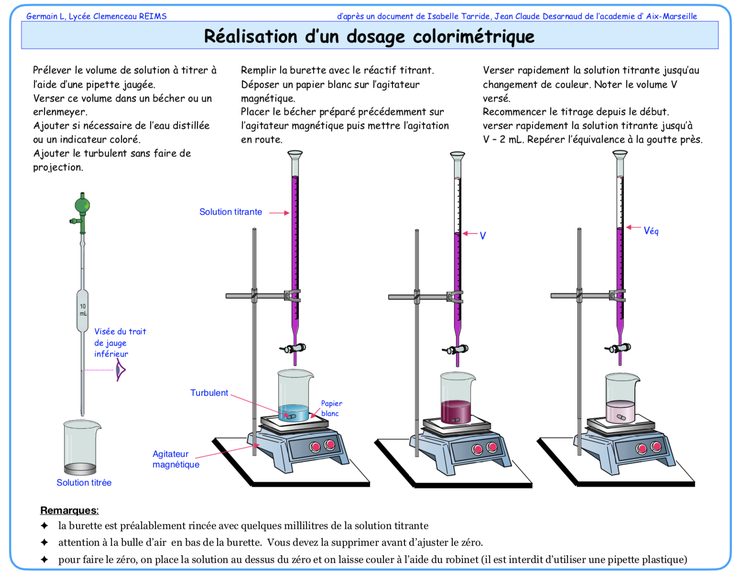
Le but de tout dosage est de déterminer la concentration inconnue ( via la quantité de matière ) d'une espèce ( titrée ) à l'aide d'une autre espèce (titrante) de concentration connue. Le point d'équivalence entre les quantités de matières présentes et celles introduites permet après quelques calculs la détermination de la concentration de l'espèce recherchée. Plusieurs méthodes sont possibles afin de déterminer ce point d'équivalence : l'introduction d'un indicateur coloré, la valeur du pH, la valeur de la conductance de la solution.


Dosage colorimétrique de l’acide chlorhydrique par la soude.
Tracer le graphe représentant la valeur du pH= f(VB).
-
Chat
-
Forum
-
Feedback
-
Le dosage consiste à déterminer la normalité d'une solution réductrice connaissant celle de la solution oxydante. On se propose d'étudier l'oxydation de l'ion Fe2+ par l'ion permanganate MnO4 - en milieu acide. Ce dosage est appelé manganimétrie. Les propriétés oxydantes de l’ion permanganate sont à l’origine de la manganimétrie. La forme oxydante MnO4 - est violette, la forme réductrice Mn2+ est incolore, ce qui permet de déterminer le point équivalent sans utiliser d’indicateurs colorés.



- Dosage du fer dans le sulfate ferreux par le permanganate de potassium.
- Ecrire les demi-réactions d’oxydo- réduction, préciser les couples redox.
-
Chat
-
Forum
-
Feedback
-
Le vinaigre est un vin (l'alcool) rendu aigre par fermentation acétique et employé comme condiment ou conservateur. On considérera que le vinaigre est une solution aqueuse d’acide acétique de densité d voisine de 1. Le but de ce TP est de déterminer le degré d’acidité D ou (°) d’un vinaigre et défini comme la masse d’acide acétique ou éthanoïque pur contenu dans 100g de vinaigre. Pour cela, on dosera l’acide acétique (éthanoïque) contenu dans un volume connu de vinaigre à l’aide d’une solution de base forte de concentration connue : solution d’hydroxyde de sodium (NaOH).

Lors des dosages, il faut connaître avec précision la concentration de la solution titrante (ici NaOH). Or dans la plupart des cas, les concentrations des solutions ne sont pas rigoureusement exactes car :
- la solution est réalisée à l’aide d’un produit solide dont la pureté n’est pas garantie par le fabricant.
- la solution est réalisée à l’aide d’un produit dont le prélèvement (pesée, volume) ne peut être précis.
- la composition chimique de la solution évolue au cours du temps.

Comment contrôler la qualité d’un produit par dosage.
Produits testés : différents types de vinaigre du commerce.
-
Chat
-
Forum
-
Feedback
-
يرجى من الطلبة الافاضل الإجابة على أسئلة الاختبار الموجودة ادناه
* الاختبار متاح ابتداء من يوم الخميس 28 / 01/ 2023.
* الاختبار يكون من الساعة 8:00 صباحا الى 15:00 مساء.
* مدة الاختبار 20 دقيقة.
* كل طالب لدية فرصة واحدة للإجابة لابد من اغتنامها.
* يرجى مراجعة الاعمال التطبيقية قبل البدأ في الاختبار.
* الأعمال التطبيقية المعنية بالإختبار هي من العملي من 1 الى 4
* إضغط على Test TP Chimie 1 وأبدأ الإختبار
حظ وفير للجميع



-
يرجى من الطلبة الافاضل الإجابة على أسئلة الاختبار:
* الاختبار متاح ابتداء من يوم الخميس 28 / 01/ 2023.
* الاختبار يكون من الساعة 8:00 صباحا الى 15:00 مساء.
* مدة الاختبار 20 دقيقة.
* كل طالب لدية فرصة واحدة للإجابة لابد من اغتنامها.
* يرجى مراجعة الاعمال التطبيقية من 1 الى 4 قبل البدأ في الاختبار.
-
-
1. Jean Toullec, Monique Mottet, Analyse chimique quantitative de Vogel, De Boeck, 2006.
2. Claudine Buess-Herman, Josette Dauchot, Chimie analytique, De Boeck 3éme Édition, 2015.
3. Philippe Ribière, TP de Chimie des solutions, MPSI, 2012.
4. Michel Soustelle, Equilibres chimiques, ISTE Editions, 2015.
