TP Chimie 2 2022-2023 (G24, G25, G26, G27, G28)
Topic outline
-
-
Forum
-
-

SOCLE COMMUN ST
Bouziane Mokhtar

E-mail :mokhtar.bouziane@univ-msila.dz
-
Ces séances de travaux pratiques est destiné aux étudiants de la 1ère année Socle commun, Le module de travaux pratiques de chimie II sont composés de quatre manipulations:
1. La Chaleur Spécifique et la Capacité Calorifique du Calorimètre.
2. La Chaleur Latente de Fusion de la Glace.
3. Détermination des Enthalpies de Réaction.
4. La Cinétique Chimique : AUTO-CATALYSE.
Chaque travail pratique est accompagné de renseignements théoriques et des questions sont proposées, afin de contrôler l’acquisition et l’assimilation des connaissances. et Chaque manipulation est sanctionnée par un compte-rendu remis à l'enseignant dans un délais maximum de 15 jours à compter de la date de la manipulation.
-
La capacité calorifique C d’une substance est la grandeur physique qui détermine la quantité de chaleur Q nécessaire pour faire varier sa température d’une certaine valeur ∆T. Nous savons, par expérience, que la capacité calorifique est une propriété extensive, dans le sens où la capacité calorifique d’un échantillon donné est directement proportionnelle aux dimensions de celui-ci (il est plus rapide de chauffer un verre d’eau qu’un baril d’eau en utilisant une même source de chaleur). La capacité thermique massique est la capacité calorifique rapportée à la masse de la substance. C’est une quantité intensive, parce qu’elle ne dépend que de la nature de la substance et non de ses dimensions

Objectifs

1. Détermination de la Capacité calorifique du calorimètre.
2. Détermination de la chaleur massique d'un métal.
-
Chat
-
Feedback
-
Forum
-
A pression constante, pour un corps pur (comme l’eau) ayant atteint sa température de changement d’état, il lui faut une quantité d’énergie supplémentaire pour changer d’état : c’est l’énergie massique de changement d’état (appelée aussi « chaleur latente de changement d’état »), notée L. On la mesure par la variation d’énergie thermique Q, telle que :
Q = m.L, m étant la masse.
Objectifs

1. Détermination de la Capacité calorifique du calorimètre.
2. Détermination de la chaleur latente de fusion de la glace.
-
Chat
-
Feedback
-
Forum
-
Les transformations que subit la matière s’accompagnent d’un dégagement ou d’une absorption d’énergie. Une réaction qui dégage de la chaleur est dite réaction Exothermique, celle qui absorbe de la chaleur est dite réaction Endothermique.
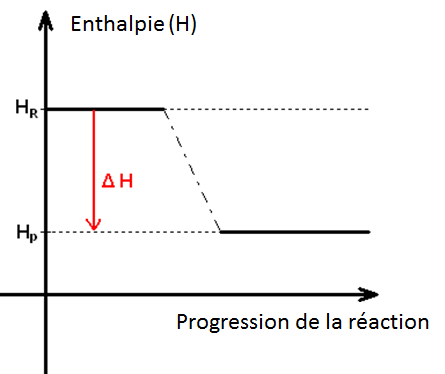
Objectifs

1. Détermination de la capacité calorifique du calorimètre.
2. Mesure de l’enthalpie de la dissolution de sel du KCl dans l’eau
3. Mesure de l’enthalpie de la dilution d’une solution de HCl.
-
Chat
-
Feedback
-
Forum
-
La cinétique chimique a pour objet d’étudier la vitesse de formation, de proposer des mécanismes, donc de définir des chemins réactionnels.
Les réactions chimiques ne sont pas toutes égales face au temps : certaines réactions sont si rapides comme les réactions acido-basiques, d'autres sont très lentes comme par exemple la formation du pétrole .
Bien avant de s'intéresser aux constituants de la matière — atomes ou molécules — les chimistes se sont posés la question de ces différences : comment expliquer qu'une réaction (par exemple, une estérification) prend 23 ans à se réaliser dans la nature, mais se complète en un quart d'heure (15 min) si on chauffe et on acidifie le milieu ?
Avant même de pouvoir répondre, il faut se poser une question encore plus élémentaire : comment mesurer la « vitesse » d'une transformation chimique ?
Objectifs

1. Étude cinétique de l’évolution d’un système par analyse chimique.
2. Quel est le rôle d'un catalyseur (Autocatalyse).
-
Chat
-
Feedback
-
Forum
