La théorie du champ cristallin
Weekly outline
-
La chimie quantique est une branche de la chimie théorique qui applique la mécanique quantique aux systèmes moléculaires pour étudier les processus et les propriétés chimiques. Le comportement électronique et nucléaire des molécules étant responsable des propriétés chimiques ne peut être décrit adéquatement qu'à partir de l'équation du mouvement quantique équation de Schrödinger et des autres postulats fondamentaux de la mécanique quantique. Cette nécessité a motivé le développement de concepts (notamment orbitale moléculaire, ...) et de méthodes de calculs numériques qui ont permis à la chimie moderne de faire des progrès considérables tant en ce qui concerne la compréhension des phénomènes que des applications.
la chimie théorique peut aider à confirmer un mécanisme en chimie organique et ainsi d'améliorer la structure de catalyseurs par exemple, d'expliquer le magnétisme moléculaire... Elle permet aussi d'approfondir nos connaissances fondamentales sur les molécules, les groupements fonctionnelles, la spectroscopie... Bref, elle offre désormais un socle mathématique à la chimie, dans la limite des "petits" systèmes qui nous permet de comprendre et donc de "prédire" des comportements moléculaires
-
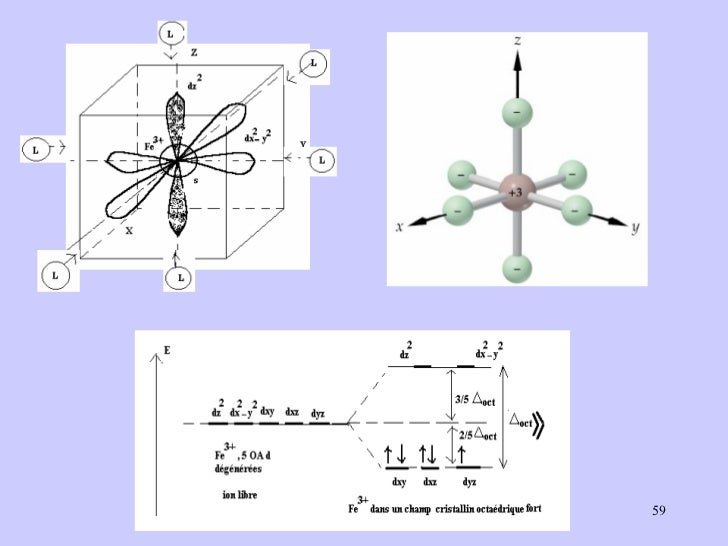
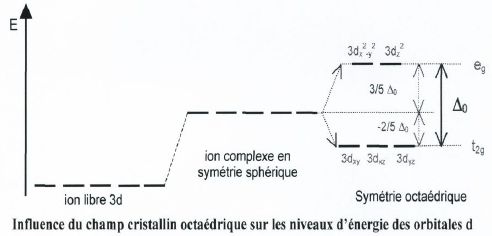
La théorie du champ cristallin est un modèle purement électrostatique qui prend en compte la répulsion entre les électrons d du centre métallique et les électrons des ligands. Au départ, les ligands sont éloignés à l’infini de l’ion métallique ; lorsqu’on les rapproche, l’attraction électrostatique assure la stabilité du complexe. Toutefois, les orbitales d du métal sont déstabilisées par la répulsion exercée par les électrons des ligands. Mais elles ne le sont pas toutes de la même manière : alors que dans l'ion libre (symétrie sphérique) les 5 orbitales d sont dégénérées, il n'en est donc plus de même dans un complexe

-
Public cible
Le champ cristallin est destiné aux étudiants de 3ieme année d'enseignement supérieur de spécialité chimie physique.
- · Enseignante : Lemmouchi Meriem. Contacts
: meriem.lemmouchi@univ-msila.dz
- · Coefficient : 03 .Crédits : 06
- · Volume horaire global: 67 heures et 30 min.
- · Volume horaire de travail requis/semaine: 4h et 30 min, (3h min cours, 1h 30 min TD et 2h de TP)
- · Modalité d’évaluation: Autoévaluation + évaluation formative + évaluation
sommative...
- · Modalité de suivi (calendrier du tutorat): hebdomadaire.
- · Enseignante : Lemmouchi Meriem. Contacts
: meriem.lemmouchi@univ-msila.dz
-
Ce cours résume les grandes notions développées dans lecadre du champ cristallin.Les objectifs de ce cours sont :
- Connaitre les principes et les fonctions du champ cristallinappliqués à la chimie.
- Savoir calculer le compte électronique des complexes.
- Déterminer les complexes qui ont un champ fort
- Déterminer les complexes qui ont un champ faible
- Savoir analyser et déterminer les complexes paramagnétique et diamagnétique

-
Pour pouvoir tirer le maximum de ce cours il faut :
- Connaître les différentes géométries des complexes de métaux de transition (coordinence 4 et 6 en particulier).
- Comprendre les effets favorisant la formation de complexes (effet chélate, influence du métal).
- Maîtriser les notions de base relatives aux chimie théorique (Au moins maîtriser les outils informatiques car les travaux pratique de la chimie théorique se base sur des logiciels informatiques).
- faire la différence entre les différent types du champ cristallin ( en particulier champ cristallin octaédrique et tétraédrique)
-
Le champ cristallin est destiné aux étudiants de 3ieme année d'enseignement supérieur de spécialité chimie physique. Le premier chapitre introduit les notions fondamentales et les premières définitions utilisées dans le cadre du champ cristallin. Le deuxième chapitre analyse le champ cristallin octaédrique et leurs différentes propriétés. Le troisième chapitre présente les autres différentes formes du champ cristallin.
-
Un complexe de coordination peut être défini comme une entité composée d’un ou plusieurs atomes métalliques constituant un cœur entouré d’un certain nombre de molécules ou d’ions appelés ligands. Cette entité peut être électriquement neutre ou chargée positivement ou négativement ; donc un ion métallique accepte une ou plusieurs paires d’électrons par les sites donneurs libres pour former une liaison de coordination.
les objectifs de chapitre 1:
- Connaître les définitions d'un ligand, métaux de transitions et un complexe de métaux de transitions
- Maîtriser la règle de 18 électrons.
- Connaître la formes des orbitales d des métaux de transitions.
-
File
-
SCORM package
-
Glossary
-
Wiki
-
Choice
-
Quiz
-
File
-
Assignment
-
champ cristallin octaédrique
les objectifs de chapitre 2:
- connaitre le champ cristallin octaédrique.
- Déterminer les complexes qui ont un champ fort
- Déterminer les complexes qui ont un champ faible
- Savoir analyser et déterminer les complexes paramagnétique et diamagnétique.
-
File
-
SCORM package
-
File
-
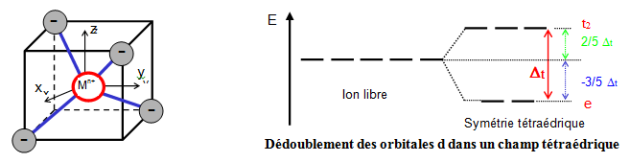
Dans la coordination tétraédrique, les niveaux d'énergie des orbitales d éclatent à nouveau en 2 niveaux d’énergie ‘e’ et ‘t2’.
Cette coordination est liée de près à la géométrie cubique qui constitue ainsi un point de départ commode pour obtenir le diagramme de dédoublement des orbitales par le champ cristallin pour le complexe ML4.
Dans la disposition tétraédrique (on enlève un ligand sur deux des sommets du cube), les ligands ne s’approchent directement d’aucune des orbitales d du métal, mais ils viennent plus près des orbitales dirigées vers le milieu des arêtes du cube (dxy, dxz et dyz) que celles qui sont dirigées vers le centre des faces (dz2 et dx2-y2). Les orbitales déstabilisées sont donc dxy, dxz et dyz appelées orbitales ‘t2’ et les orbitales stabilisées sont dz2 et dx2-y2 appelées
orbitales ‘e’.
les objectifs de chapitre 3:
- connaitre le champ cristallin tétraédrique.
- faire la différence entre le champ cristallin octaédrique et tétraédrique.
- savoir les autres formes du champ cristallin.
-
Forum
-
File
-
SCORM package
-
Assignment
-
-
File
-
SCORM package
-
Wiki
-
-
-
-
Survey
-
