E-learning -Université de M'sila
نتائج البحث: 5241

Cet enseignement qui se déroule au cours d’un semestre est destiné aux étudiants de 1ere année ST.

- معلم: CHENNA Malika

Objectifs de l’enseignement
L’acquisition des formalismes de base de la thermodynamique et ses principes fondamentaux introduisant les grandeurs thermodynamiques et les fonctions d’état telles l’enthalpie et l’entropie ainsi que la cinétique des réactions chimiques.
Connaissances préalables recommandées
Il est recommandé de maîtriser les mathématiques du S1 (Analyse & Algèbre 1).
Partie I
Chimie Cinétique
Introduction à la cinétique chimique :
ü Définition de la vitesse d’avancement d’une réaction.
ü Principaux facteurs influençant la vitesse des réactions chimiques, concentration, température.
ü Loi des vitesses intégrales.
ü Notion de mécanisme réactionnel.
ü Énergie d’activation et catalyse.
Partie II
Thermodynamique
Généralités sur la thermodynamique : système, état d’un système, variable et fonction d’état.
ü Notion d’équilibre et de transformation d’un système.
ü Notion de température.
ü Différentes formes d’énergie.
ü Équation des gaz parfaits.
ü Premier principe de la thermodynamique : Énergie interne, travail, chaleur. Énoncé du premier principe.
ü Application : transformation d’un gaz parfait (isochore, isotherme, isobare, adiabatique). Systèmes chimiques ; chaleur de réaction, énergie de liaison.
ü Deuxième principe de la thermodynamique : Évolutions naturelles.
ü Notions d’entropie et d’enthalpie libre.
Mode d’évaluation
Continu : 33% Examen : 67%
- معلم: Hocine Bouleghlem

"Il est recommandé d’avoir bien maîtrisé les Mathématiques dans le cycle secondaire".
- معلم: ZIDANE Salima
- معلم: BECHANE Leila
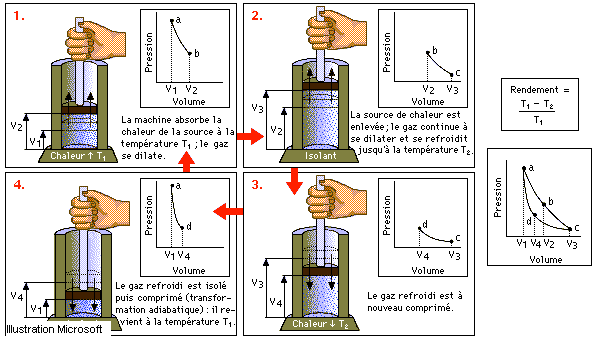
Le présent cours intitulé thermodynamique classique est destiné aux étudiants de première année tronc commun de la faculté de technologie. Il est dressé conformément au canevas établi par le ministère de l'enseignement supérieure et de la recherche scientifique (MESRS) de la république algérienne démocratique et populaire.
Le cours est réparti sur sept chapitres. Le premier traite les notions et définitions de base, ainsi que la terminologie fréquemment utilisée en thermodynamique. Vers la fin de ce chapitre on a exposé le modèle du gaz parfait comme exemple sur les systèmes thermodynamiques et les lois classiques régissant son comportement et en fin une synthèse de ces lois qui met en évidence l’équation d'état du gaz parfait PV = nRT, Quelques exemples sur les équations d'état des gaz réels sont cités à titre comparatif et la signification des paramètres y figurants, caractérisant chaque gaz réel.
Le deuxième chapitre est consacré à la thermométrie, domaine qui s'intéresse au repérage ou à la mesure de la température selon l’échelle thermométrique utilisée. Là le principe dit "Zéro" en thermodynamique est énoncé. Il est principalement à la base de la technique de mesure de la température. Mais son intérêt ne se limite pas uniquement dans le domaine de la thermométrie. Son importance est plus claire dans l'étude des équilibres thermiques internes des systèmes thermodynamiques et éventuellement avec le milieu extérieur avec lequel ils interagissent. Dans ce chapitre les échelles de mesure de température sont passées en revue. Un accent particulier est mis sur les échelles linéaires et plus particulièrement celles appelées centésimales. évidemment pour terminer, quelques types de thermomètres et leurs principes de fonctionnement sont exposés. Un type particulier de thermomètre appelé pyromètre, dont le principe de fonctionnement est différent est cité vers la fin.
Le chapitre trois traite le premier principe en thermodynamique ou principe de conservation de l'énergie. Dans un premier temps il est mis en évidence deux grandeurs de transfert en l’occurrence; le travail et la chaleur, qui sont décrits séparément comme étant deux formes d'énergie, dont la différence réside dans leur impact sur le système. Par la suite le premier principe est énoncé en admetant l’existence d'une certaine fonction d'état appelée énergie interne et notée U, dont la variation est due aux échanges de travail et de la chaleur. Quelques conséquences sont tirées immédiatement de ce principe comme celui d'un système isolé. Plus particulièrement une nouvelle fonction d'état appelée enthalpie et notée H est introduite pour étudier les transformations monobares ou isobares. Plus loin dans ce chapitre, l’application du premier principe au modèle du gaz parfait a mis en évidence deux lois du gaz parfait; première et deuxième loi de Joule. Ces deux lois ont permit un calcul facile des grandeurs énergétiques du gaz parfait au cours de transformations simples.
Le chapitre quatre est consacré à l'application du premier principe au réactions chimiques appelée communément la thermochimie. C'est un domaine qui s’intéresse au calcul de la chaleur accompagnant les réactions chimiques, désignée par chaleur de réaction. On distingue principalement entre eux types de chaleurs; les chaleurs à volume constant et les chaleurs à pression constante, qui sont calculées par la variation de l'énergie interne U et la variation de l'enthalpie H respectivement. C'est un outil très précieux du moment qu'il nous permet de calculer la chaleur de réaction sans avoir recours à effectuer réellement la réaction considérée, tout en se basant sur un ensemble de valeurs tabulées appelées enthalpies de formation et/ou les chaleurs de réactions calculées ou mesurées auparavant.
Si le premier principe nous permet de tracer un bilan énergétique au bout d'une transformation donnée, il ne peut pas prévoir le sens de spontanéité (le sens de l'irréversibilité) de celle-ci. Justement et dans le cadre du premier principe les deux sens de la transformation sont possibles du moment que le bilan énergétique est bien vérifié. Pratiquement on a constaté qu'une transformation spontanée dans un sens ne peut avoir lieu dans l'autre sens. C’est là qu'intervient le deuxième principe en thermodynamique (sujet du cinquième chapitre). Ce principe prévoit le sens de spontanéité d'une transformation, Donc l'impossibilité de l'autre. Pour se faire on a introduit un nouveau concept celui de l' "Entropie" , notée S. Une transformation spontanée est toujours accompagnée d'une augmentation de l'entropie jusqu'à atteindre sa valeur maximale. Il a été prouvé statistiquement que l'entropie est proportionnelle au désordre dans le système ce que signifie que le désordre sera maximale au bout de la transformation spontanée. Une formulation mathématique est mise en évidence pour exprimer la variation de l'entropie au cours d'une transformation quelconque (réversible ou irréversible). Des calculs détaillés sur l'entropie sont effectués pour le cas d'un gaz parfait subissant des transformations simples (réversible ou irréversible)
Le troisième principe en thermodynamique, exposé au chapitre six, appelé encore le théorème de Nernst, du nom du Prix Nobel qui l'a découvert en 1906, s'énonce de la façon suivante : " L'entropie d'un système quelconque peut toujours être prise égale à zéro à la température du zéro absolu". Il en découle directement que la variation d'entropie molaire d'une substance monophasique uniforme au cours d'une transformation isobare qui fait passer sa température de T0 à T est calculable par :
Donc l'entropie absolue d'une substance monophasique uniforme est calculable pour une température donnée, chose qui n'est pas possible pour l'énergie interne U.
Dans le dernier chapitre (chapitre VII) les équilibres chimiques en phase gazeuse sont étudiés. Deux fonctions d'état sont utilisées dans ce but ; fonctions de Helmholtz et de Gibbs
- معلم: BOUACHA Samir
Résumé de Topographie I/L2GC
Ce cours de Topographie1 est proposé pour le cycle 2éme année Licence en GC ,l’approche concrète qu’il propose est une aide pour le cours de Topographie 2 proposés lors de la 3éme année Licence.
Dans ce cours vous serez en mesure de connaître les bases des mesures angulaires et de distances. Savoir reconnaître et utiliser les termes utiles en topographie (matériels,
méthodes, erreurs, fautes etc.). Savoir utiliser l'instrument topographique THÉODOLITE.
Ce cours vous permet de :
- Comprendre, identifier, savoir corriger ou éliminer les erreurs et les fautes opératoires et/ou méthodologiques courantes dans les mesures d’angles et distances.
- Acquérir les techniques calculatoires des angles horizontaux et verticaux ainsi que les altitudes
Objectifs de l’enseignement :
L’étudiant sera en mesure de connaître les bases de la topographie lui permettant réaliser et contrôler ultérieurement l’implantation d’une construction, nivellement, mesure des angles et coordonnées, tracé des plans topographiques.
- معلم: BENIA Mounir
cours de topo pour la 2ème année licence.
L'étudiant sera en mesure de connaitre les bases de la topographie lui permettant de réaliser et contrôler, l'implantation d'une construction, nivellement, mesure des angles et coordonnées,le tracer des plans topographiques.
Module de topographie 2 pour les étudiant de la 3eme année Licence Génie Civil
L'étudiant doit être capable de réaliser et contrôler une implantation d'un ouvrage ou de parties d'ouvrage sur le terrain.

Le cours " Toxicité microbienne et sécurité Alimentaire " est destiné aux étudiants : 1er année master en Microbiologie Appliquée.
Parmi les objectif de ce cours est d'acquérir des connaissance sur l'importance du processus d'analyse des
risque pour réduire le taux de toxi-infection alimentaire, et dans ce cas les
microorganismes pathogènes les plus incriminés dans des cas de toxi-infections
alimentaires sont caractérisés.
Contenu de la matière :
1. Généralités sur les risques alimentaires, toxi-infections alimentaires : étude des bactéries les plus impliquées dans les toxi-infections d’origine alimentaire, généralités sur les biofilms (adhésion, colonisation, détachement, résidence)
2. Epidémiologie et études des bactéries les plus impliquées dans les TIA
3. Moisissures toxinogènes, production des mycotoxines (structure, toxicité, méthodes de détection, secretion….), moyens de lutte. .
4. Bactéries et toxines incriminées dans les toxi-infections,
5. Les champignons filamenteux producteurs de mycotoxines

Ce cours aborde un domaine très important dans la sécurité alimentaire et survol les principales menaces d'origines alimentaires qui peuvent affecter la santé des consommateurs. il permet d’inculquer aux étudiants des notions sur la caractérisation des risques liés à la santé, biologique, physique et chimique, en relation avec notre alimentation ; l’identification des dangers et la gestion du risque sous tous ses aspects technologique, sociologique et législatif.
Les étudiants qui suivent ce cours doivent avoir des prérequis sur la microbiologie, la biochimie, la toxicologie et les technologies alimentaires.
En plus du cours, l’étudiant doit
réaliser des travaux personnels sous formes de travaux pratiques et des exposés
sur des thèmes liés aux chapitres du cours.
- معلم: cherif kamel

Les travaux Pratiques de cette matière ont comme :
Objectifs de l’enseignement:
Cette matière apporte à l’étudiant certains outils expérimentaux pour la caractérisation rhéologiques et mécaniques de certains matériaux et leur durabilité
- BELAGRAA: larbi belagraa
- معلم: hani benguesmia

Ce cours de Conception Fabrication Assistée par Ordinateur s'adresse aux étudiants de deuxième année master spécialité electromécanique, filière de génie électrique, domaine Technologie (Semestre 3). Il permettra aux étudiants de perfectionner les connaissances des étudiants dans le domaine de la CFAO. A la fin du semestre, l’étudiant devra acquérir les compétences suivantes :
- Modélisation des pièces de formes complexes (moules, matrices, ...).
- Simulation du processus d’usinage.
- Interprétation et vérification du programme d’usinage généré automatiquement.


