Travaux pratiques Chimie II (G09, G13, G21, G25, G29)
مخطط الموضوع
-

La thermodynamique est une science fondamentale qui traite des transformations d'énergie au sein d'un système. Elle s'intéresse à l'énergie échangée lors d'une transformation réversible ou irréversible d'un point de vu chimique et physique (travail, chaleur...). On étudie généralement sur un plan macroscopique les transformations d'un système évoluant d'un état initial et d'un état final.
Ces travaux pratiques de thermodynamique dédiés aux étudiants de scole commun ST sont subdivisés comme suit:
- TP N°1 : Chaleur Spécifique
- TP N°2 : La Chaleur Latente
- TP N°3 : Enthalpies de Réaction
- TP N°4 : AUTO-CATALYSE
-
منتدى
-
La thermodynamique est la science qui étudie les échanges d'énergie. On l'utilise autant en physique qu'en chimie ou en biologie, en s'appuyant notamment sur des outils mathématiques. Elle nous permet de comprendre et de prévoir les variations d'énergie entre différents systèmes en interaction grâce à des principes fondamentaux. Les applications de la thermodynamique sont nombreuses. On peut citer entre autres les machines thermiques (moteurs de voitures, réfrigérateurs, pompes à chaleur).
-
الملف
-
الملف
-
ورشة العمل
-
الواجب
Déposez ici votre compte rendu
-
Un corps pur donné peut se présenter sous 4 états : solide, liquide, gazeux et plasma.
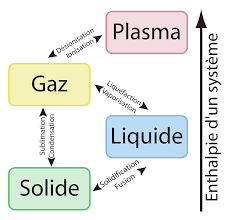
Le changement d’état physique nécessite un échange de chaleur avec le milieu extérieur.
Un changement physique se produit lorsqu'il n'y a pas transformation de la matière
Exemple, l’eau liquide qui s'évapore reste toujours de l'eau, H2O
mais ce changement physique est accompagné d'un dégagement ou absorption de chaleur selon le cas.
-
الملف
-
الملف
-
منتدى
-
الواجبDéposez ici votre compte rendu
-

Les transformations que subit la matière s’accompagnent d’un dégagement ou d’une absorption d’énergie. Une réaction qui dégage de la chaleur est dite réaction Exothermique, celle qui absorbe de la chaleur est dite réaction Endothermique.
-
الملف
-
المجلد
-
المحادثة
-
الواجب
Déposez votre compte rendu ici
-
La cinétique chimique a pour objet d’étudier la vitesse de formation, de proposer des mécanismes, donc de définir des chemins réactionnels. Les réactions chimiques ne sont pas toutes égales face au temps : certaines réactions sont si rapides comme les réactions acido-basiques, d'autres sont très lentes comme par exemple la formation du pétrole.
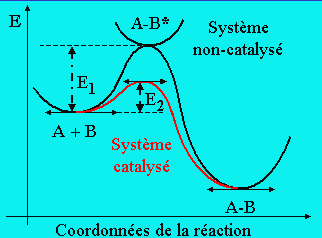 Bien avant de s'intéresser aux constituants de la
matière — atomes ou molécules — les chimistes se sont posés la question de ces
différences : comment expliquer qu'une réaction (par exemple, une estérification)
prend 23 ans à se réaliser dans la nature, mais se complète en un quart d'heure
(15 min) si on chauffe et on acidifie le milieu ?
Bien avant de s'intéresser aux constituants de la
matière — atomes ou molécules — les chimistes se sont posés la question de ces
différences : comment expliquer qu'une réaction (par exemple, une estérification)
prend 23 ans à se réaliser dans la nature, mais se complète en un quart d'heure
(15 min) si on chauffe et on acidifie le milieu ?Avant même de pouvoir répondre, il faut se poser une question encore plus élémentaire : comment mesurer la « vitesse » d'une transformation chimique ?
-
الملف
-
المجلد
-
ويكي
-
الواجب
Déposez ici votre compte rendu
-
-
-
-
-
-
-

