Travaux dirigé structure de la matière
مخطط الموضوع
-
-
الواجب

Titre du matière : Travaux dirigés structure de la matière 1
Faculté : Technologie
Département : tronc coummun
Cycle : 1èr année Licence
Semestre : 1
Crédits : 5
Coefficients : 4
Volume : 1h30
Enseignant : Mohamed amine.GHEBOULI
Email :mohemedamine.ghebouli@univ-msila.dz.
-
-

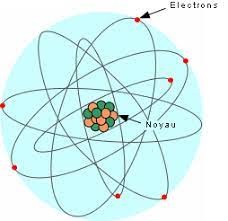
- Cette série d'exercices est consacrée à l'étude des différents paramètres d'un atome. On cite comme grandeurs la charge électrique, la masse atomique, le numéro atomique, le nombre de nucléons, le nombre d'électrons périphériques présents dans la sous couche externe et la structure d'un atome.
-
المحادثة
-
الإفادة
-
-

-
المحادثة
-
-
Objectif
- Cette série d'exercices est consacrée à l'étude des différents paramètres d'un atome. On cite comme grandeurs la charge électrique, la masse atomique, le numéro atomique, le nombre de nucléons, le nombre d'électrons périphériques présents dans la sous couche externe et la structure d'un atome.
- On définit l'unité de masse atomique et on introduit les notions de masses théorique et réelle d'un noyau. On illustre aussi les grandeurs telles que de défaut de masse et l'énergie de cohésion d'un noyau.
-
الملف
-
المحادثة
-
الإفادة
-
منتدى
-
-
Objectif
- Dans la seconde série, on étudie l'atome d'hydrogène ou un hydrogénoïde en utilisant le modèle de Bohr. Le résultat montre que les rayons sont quantifiés et leurs valeurs sont exprimés en fonction du nombre quantique principal, du nombre de charge et du rayon de la première orbite.
- L'effet de l'ordre et du numéro atomique sur le rayon d'orbite d'un hydrogénoïde est traité. Les énergies des différentes ionisations d'un atome ont été discutées. Les longueurs d'ondes des différentes raies spectrales et les longueurs d'ondes limites, ainsi que leurs domaines spectrales électromagnétique ont été reportées.
- L'effet de l'attraction noyau-électron est à courte distance. L'énergie absorbée par un ion quand l’électron passe du niveau fondamental à un niveau excité a été déterminée. Les séries spectrales de Lyman, Balmer, Pashen et Brackett ont été étudiées.
- L'énergie, la fréquence, la longueur d'onde, le domaine spectral et la série de ces raies sont représentées.
- Le domaine spectral des séries de Lyman, Balmer et Pashen est respectivement l'ultra-violet, le visible et l'infra rouge.
-
الملف
-
المحادثة
-
الإفادة
-
الإفادة
-
المجلد
-
-
Objectif
- On donne dans cette série les dimensions de deux grandeurs principales et dans les systèmes et.
- La longueur d'onde de De Broglie associée à un électron d'énergie connue ou à un proton dans un potentiel quelconque sont déterminées. On détermine la fonction d'onde liée à une orbitale de l’atome d’hydrogène.
- On calcule la densité de probabilité de présence radiale, la probabilité de présence d'un électron à l’intérieur d’une sphère et le nombre d’orbitales dans les trois premiers niveaux d’énergie de l’atome d’hydrogène.
- On détecte les structure qui sont à l'état fondamental de celles qui sont dans un état excité. on énonce les règles et principes qui permettent d’établir la structure électronique d’un atome.
- On applique les règle de stabilité, de Pauli, de Klechkowski et de Hund pour le remplissage électronique.
-
الملف
-
المحادثة
-
الإفادة
-
منتدى
-
-
Objectif
- Ce chapitre traite la structure électronique, la disposition spatiale et le nombre d’électrons de valence. On classe les éléments par période et par groupe et on spécifie leurs caractéristiques physicochimiques.
- La réaction d'ionisation du et celles de ces ions possibles et l'énergie d'ionisation sont calculées. On détermine la charge nucléaire effective d'un électron sur une orbitale et l'électronégativité des éléments dans l’échelle de Pauling.
-
الملف
-
المحادثة
-
الإفادة
-
منتدى
-
-
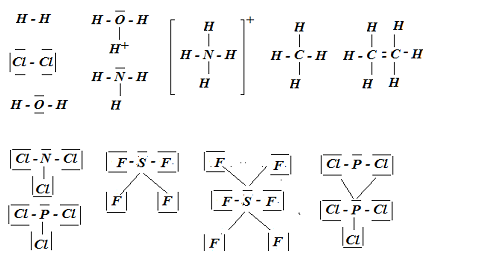
Objectif
- On représente dans cette série les éléments selon le modèle de Lewis. On applique le diagramme énergétique des orbitales moléculaires OM et la structure électronique moléculaire des espèces chimiques.
- On calcule le nombre et la longueur de liaison et l'énergie de dissociation.
- On classe les espèces chimiques par ordre de stabilité.
- On détermine la nature et la polarité des liaisons chimiques.
- On classe les molécules selon leur point d'ébullition et leur force de liaison.
-
المحادثة
-
الإفادة
-
منتدى
-
الملف
-
-
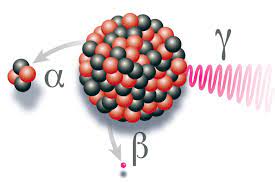
La radioactivité est le phénomène physique par lequel des noyaux d'atomes instables (dits radionucléides ou radioisotopes) se transforment spontanément en d'autres atomes en émettant simultanément des rayonnements, c'est-à-dire des particules de matière. On dit alors qu'ils sont radioactifs.
-
المحادثة
-
الإفادة
-
المجلد
-
-
:- https://fr.wikipedia.org/wiki/Atome
- https://fr.wikipedia.org/wiki/Radioactivit%C3%A9
- https://fr.wikiversity.org/wiki/Constitution_de_la_mati%C3%A8re/Structurede
l'atome
- Chimie Générale ; MD 1105 ; D. Peeters, E. Sonveaux, Faculté de médecine,
Université catholique de Louvain.
- Cours de chimie 1 ; A. Benmachiche ; Faculté de médecine ; Université des frères
Mentouri Constantine 1 ; 2015-2016.
- Cours de chimie 1er année médecine, Pr. B. Legseir; Faculté de médecine; Université
Badji Mokhtar, Annaba ; 2015-2016.
