TP CHIMIE 2 (S2) (2022/2023)
Aperçu des sections
-
-
Forum
-
-

Enseignant : Dr. MAKHLOUFI El-Hani
Contact : elhani.makhloufi@univ-msila.dz
Disponibilité : Au Laboratorie : Mercredi- Jeudi de 08h00 -17h00
Informations sur le cours :
Faculté : Technologie
Département : Socle Commun ST
Public cible : 1ère année Licence
Intitulé du cours : TP Chimie 02
Crédit : 02
Coefficient :01
Durée : 10 semaines
Horaire : 02h00
Bloc: B
Salle : Labo: 5,7,8 et 9.
2023-2024
-
Ces séances de travaux pratiques est destiné aux étudiants de la 1ère année Socle commun, Le module de travaux pratiques de chimie II sont composés de quatre manipulations:
- Manipulation N°1 : Capacité calorifique et Chaleur spécifique
- Manipulation N°2 : Chaleur latente de fusion de la glace
- Manipulation N°3 : Détermination des enthalpies de réaction
- Manipulation N°4 : Cinétique chimique : AUTO-CATALYSE
Chaque travail pratique est accompagné de renseignements théoriques et des questions sont proposées, afin de contrôler l’acquisition et l’assimilation des connaissances. et Chaque manipulation est sanctionnée par un compte-rendu remis à l'enseignant dans un délais maximum de 15 jours à compter de la date de la manipulation.
-
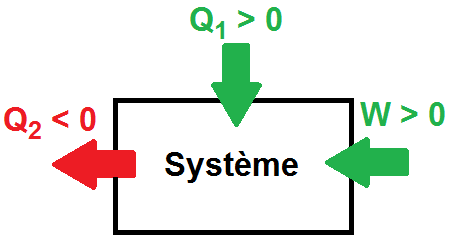
Thermodynamics is the science of energy exchange. It is used as much in physics as in chemistry and biology, relying in particular on mathematical tools. Its fundamental principles enable us to understand and predict energy variations between different interacting systems. Thermodynamics has many applications. These include thermal machines (car engines, refrigerators, heat pumps).
The calorific capacity C of a substance is the physical quantity that determines the amount of heat Q required to vary its temperature by a certain value ∆T. We know from experience that calorific capacity is an extensive property, in the sense that the calorific capacity of a given sample is directly proportional to its dimensions (it is faster to chauffer a glass of water than a barrel of water using the same heat source). The mass heat capacity is the calorific capacity related to the mass of the substance. It is an intensive quantity, because it depends only on the nature of the substance and not on its dimensions.

Objectives
1- Determine the calorific capacity of the calorimeter.
2- Determining the specific heat of a liquid (ethanol).
3- Determining the specific heat of a metal.
ENG
 FR
FR
-
Chat
-
Feedback
-
Forum
-
Un corps pur donné peut se présenter sous 4 états : solide, liquide, gazeux et plasma, Le changement d’état physique nécessite un échange de chaleur (énergie) avec le milieu extérieur.
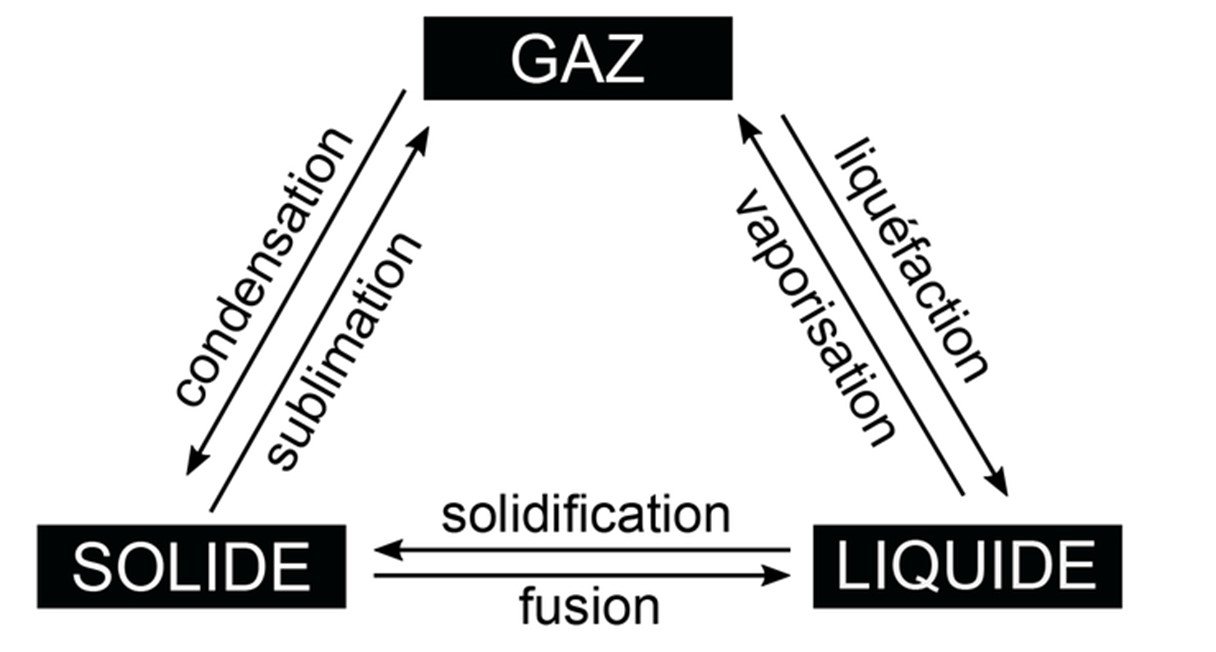
Un changement physique se produit lorsqu'il n'y a pas transformation de la matière comme par Exemple, l’eau liquide qui s'évapore reste toujours de l'eau, H2O.
A pression constante, pour un corps pur (comme l’eau) ayant atteint sa température de changement d’état, il lui faut une quantité d’énergie supplémentaire pour changer d’état : c’est l’énergie massique de changement d’état (appelée aussi « chaleur latente de changement d’état »), notée L. On la mesure par la variation d’énergie thermique Q, telle que :
Q = m . L m: étant la masse en Kg.
Objectifs

Etude des phénomènes de changements d'état.
- Détermination de la Capacité calorifique du calorimètre (Ccal).
- Détermination de la chaleur latente de fusion de la glace (Lf).

-
Chat
-
Feedback
-
Forum
-
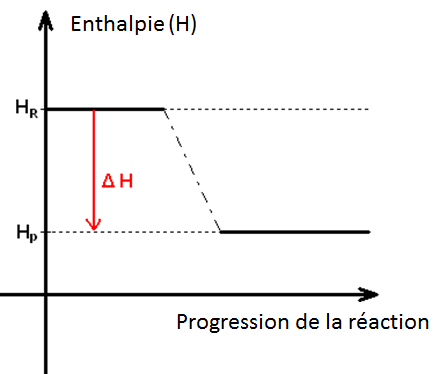
Dans toute réaction chimique, de la chaleur est soit absorbée, soit dégagée. Cet échange de chaleur entre une réaction chimique et son environnement immédiat est connu sous le nom d'enthalpie de la réaction ou encore « H ». Cette enthalpie ne peut pas être mesurée directement, les scientifiques se servent alors de la « variation » de température entre le début et la fin de la réaction, ce qui permet ensuite de calculer la « variation » d'enthalpie dans le même laps de temps (variation notée ∆H). À l'aide du ∆H, les scientifiques sont capables de dire si une réaction a été « exothermique » (perte ou dégage de la chaleur durant la réaction) ou « endothermique » (absorption de chaleur). En général, a Pression Constante ( ∆H = Q = m.c.∆T ) , avec m représentant la masse des composants, c la chaleur spécifique du produit et ∆T étant la variation de température durant la réaction.
.
Objectifs

- Détermination de la capacité calorifique du calorimètre.
- Mesure de l’enthalpie de la dissolution de sel du KCl dans l’eau.
- Mesure de l’enthalpie de la dilution d’une solution de HCl.

-
Chat
-
Feedback
-
Forum
-
La cinétique chimique a pour objet d’étudier la vitesse de formation, de proposer des mécanismes, donc de définir des chemins réactionnels.
Les réactions chimiques ne sont pas toutes égales face au temps : certaines réactions sont si rapides comme les réactions acido-basiques, d'autres sont très lentes comme par exemple la formation du pétrole .
Bien avant de s'intéresser aux constituants de la matière — atomes ou molécules — les chimistes se sont posés la question de ces différences : comment expliquer qu'une réaction (par exemple, une estérification) prend 23 ans à se réaliser dans la nature, mais se complète en un quart d'heure (15 min) si on chauffe et on acidifie le milieu ?
Avant même de pouvoir répondre, il faut se poser une question encore plus élémentaire : comment mesurer la « vitesse » d'une transformation chimique ?
Objectifs

- Étude cinétique de l’évolution d’un système par analyse chimique « en continu ».
- Quel est le rôle d'un catalyseur (Autocatalyse).

-
Chat
-
Feedback
-
Forum
-

1. Lucien Borel, Daniel Favrat, Thermodynamique et énergétique, PPUR, 2005.
2. Jacques Mesplède, Jérôme Randon, 100 manipulations de chimie générale et analytique, Editions Bréal, 2004.
3. John C. Kotz, Paul M. Treichel Jr, Chimie des solutions, De Boeck Supérieur, 2006.
